- ANTIOXYGÈNES
- ANTIOXYGÈNESLe terme «antioxygène» désigne des substances qui, ajoutées à faible dose à des matières spontanément oxydables à l’air, sont capables d’empêcher l’action de l’oxygène libre, communément appelée autoxydation.Du point de vue de la terminologie, on a successivement utilisé les termes «inhibiteurs», «antioxydants», puis «antioxygènes». Le premier de ces mots a le défaut d’être vague; le second est impropre et inexact, car les substances antioxygènes n’ont pas d’action retardatrice sur les oxydants chimiques tels que l’acide chromique, le permanganate de potassium, etc.Les antioxygènes agissent par «catalyse négative», en ralentissant la vitesse de réaction. En toute rigueur, le terme catalyse est impropre ici, puisque les antioxygènes sont détruits par l’oxygène de façon irréversible (cf. CATALYSE). Il est aussi essentiel de bien distinguer leur mode d’action des autres effets protecteurs vis-à-vis de l’oxygène, notamment des procédés visant à éviter le contact direct de la matière oxydable avec l’oxygène (isolement par une couche imperméable, vernis par exemple, ou bien raréfaction de l’oxygène au voisinage du corps oxydable). Le terme «antioxygène» doit donc être strictement réservé aux agents protecteurs qui agissent par diminution de l’activité de l’oxygène sans l’écarter ou le raréfier.Les antioxygènes permettent la protection des substances oxydables contre les méfaits de l’oxygène. Aussi ont-ils reçu, peu après les premiers travaux de Charles Moureu et Charles-Robert Dufraisse en 1917, d’importantes applications industrielles: on les utilise dans des secteurs très variés, comme la lutte contre le vieillissement du caoutchouc, le gommage des carburants, le cognement des moteurs à combustion interne, le rancissement des corps gras. Bien qu’ils ne constituent pas nécessairement des inhibiteurs de polymérisation, ils sont parfois utilisés pour la stabilisation de divers monomères.1. HistoriqueL’évolution de nos connaissances sur la protection contre l’action de l’oxygène atmosphérique peut se diviser en trois périodes.Il y eut tout d’abord une période empirique (avant la découverte de l’oxygène) pendant laquelle on a cherché à se défendre contre les méfaits de l’air, sans même connaître le vrai responsable, l’oxygène. Certains procédés utilisés depuis l’Antiquité avaient pour résultat de mettre les matières périssables à l’abri de l’oxydation, d’une manière plus ou moins efficace. On avait recours, entre autres, à des préparations végétales reconnues aujourd’hui pour être riches en phénols, aux macérations tannantes, à l’enfumage, etc.Au cours de la deuxième période, les notions se précisent peu à peu. La première observation scientifique remonte à 1797: Claude Berthollet a constaté que des traces de produits sulfurés empêchaient l’oxyluminescence du phosphore. En 1843, Deschamps a montré que le benjoin supprimait le rancissement des graisses. En 1856, Eugène Chevreul a signalé que la vitesse de dessication des huiles dépendait de la nature du bois sur lequel on les étalait: on a reconnu depuis que le retard à la dessication augmente lorsque la teneur des bois en phénols s’élève. En 1848, Rump a préservé le chloroforme de l’action de l’air par addition de traces d’alcool: cette méthode de stabilisation est encore utilisée. Il faudrait également mentionner la protection du caoutchouc, signalée pour la première fois en 1908 par Wilhelm Ostwald, ainsi que celle de nombreuses autres substances. On s’est en général borné, au cours de cette période, à noter, sans en expliquer la raison, que la présence d’impuretés favorables améliorait la tenue des matières altérables.La troisième période débute en 1917 avec les travaux de Moureu, Dufraisse et de leurs collaborateurs, qui firent connaître la véritable nature du phénomène antioxygène et en établirent la généralité jusqu’alors insoupçonnée. Cette période est surtout caractérisée par l’essor prodigieux des recherches sur les antioxygènes: les données nouvelles ont soulevé un vaste mouvement d’idées et d’études expérimentales. Les applications du phénomène deviennent de plus en plus nombreuses et des milliers de brevets ont, depuis lors, été consacrés aux antioxygènes.2. AutoxydationOn désigne généralement par «autoxydation» une oxydation lente qui peut être effectuée par l’oxygène atmosphérique à des températures peu élevées, le plus souvent en phase liquide, par opposition aux processus rapides de combustion ou d’inflammation qui nécessitent des températures élevées. Ce terme ne s’applique pas au phénomène d’oxydation biologique (respiration) ni à l’oxydation des métaux (corrosion).De nombreuses substances organiques naturelles ou synthétiques, exposées à l’air, s’autoxydent. Parmi les hydrocarbures, les alcènes sont attaqués plus facilement que les alcanes; les substances contenant des groupes C 漣H tertiaires sont particulièrement sensibles à l’action de l’oxygène libre. Les éthers-oxydes et les aldéhydes sont également des composés autoxydables.L’autoxydation provoque des modifications chimiques qui altèrent les propriétés de ces produits et les rendent impropres à l’utilisation normale. Le vieillissement des substances autoxydables a été reconnu depuis longtemps, mais la compréhension du phénomène est relativement récente.Des études analytiques ont montré qu’au cours des réactions d’autoxydation, il se forme tout d’abord des peroxydes. Ceux-ci se décomposent ensuite en produits plus stables et conduisent à des mélanges souvent complexes.Il convient de signaler que, dans certains cas, l’autoxydation est une réaction intéressante: c’est ainsi que l’autoxydation du cumène (ou isoprophylbenzène) fournit un hydroperoxyde dont la décomposition est réalisée industriellement pour préparer le phénol et l’acétone.MécanismeDu point de vue de la cinétique, la réaction d’autoxydation est caractérisée par l’existence d’une période d’induction au début de la réaction, au cours de laquelle la vitesse est pratiquement négligeable. La vitesse de la réaction croît ensuite rapidement puis se stabilise.Ces faits s’accordent avec le mécanisme d’une réaction radicalaire en chaîne. Si l’on représente le composé autoxydable par la formule R 漣H, la liaison covalente entre l’hydrogène et le groupe R résulte de la mise en commun de deux électrons, l’un étant fourni par l’atome d’hydrogène et l’autre par un atome de carbone du groupe R.La réaction de départ de la chaîne (appelée aussi réaction initiatrice) consiste en la scission homolytique de la liaison R 漣 H avec formation de deux fragments (radicaux libres) comportant chacun un électron non couplé:
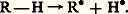 Cette réaction peut s’effectuer sous l’influence de divers facteurs qui seront précisés ultérieurement.Dans un second temps, il y a propagation de la chaîne par suite des réactions suivantes:Action de l’oxygène sur le radical R 鍊 avec formation d’un radical peroxyde:
Cette réaction peut s’effectuer sous l’influence de divers facteurs qui seront précisés ultérieurement.Dans un second temps, il y a propagation de la chaîne par suite des réactions suivantes:Action de l’oxygène sur le radical R 鍊 avec formation d’un radical peroxyde: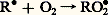 puis réaction de ce nouveau radical avec une molécule du composé autoxydable R 漣H:
puis réaction de ce nouveau radical avec une molécule du composé autoxydable R 漣H: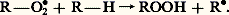 Il se forme un hydroperoxyde et il y a régénération du radical libre R 鍊 qui peut à son tour amorcer une nouvelle chaîne et ainsi de suite.La chaîne peut être interrompue par l’une des réactions de rupture suivantes:– combinaison de deux radicaux R 鍊:
Il se forme un hydroperoxyde et il y a régénération du radical libre R 鍊 qui peut à son tour amorcer une nouvelle chaîne et ainsi de suite.La chaîne peut être interrompue par l’une des réactions de rupture suivantes:– combinaison de deux radicaux R 鍊: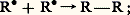 – combinaison de deux radicaux peroxydes avec libération d’oxygène:
– combinaison de deux radicaux peroxydes avec libération d’oxygène: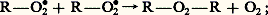 – combinaison d’un radical R 鍊 et d’un radical peroxyde:
– combinaison d’un radical R 鍊 et d’un radical peroxyde: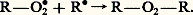 Certains hydroperoxydes sont peu stables et se décomposent spontanément en produits oxygénés. Au cours de cette transformation, il y a création de radicaux libres qui provoquent l’amorçage de nouvelles chaînes (chaînes ramifiées) et accroissent ainsi la vitesse de l’autoxydation.CatalyseLa scission homolytique de la liaison R 漣H d’un composé autoxydable peut être obtenue de diverses manières:– par irradiation ultraviolette : l’absorption d’énergie lumineuse par la substance autoxydable facilite la rupture de la liaison R 漣H;漣 par action de catalyseurs : les peroxydes organiques, en particulier le peroxyde de benzoyle, fournissent, par décomposition thermique, des radicaux libres suffisamment réactifs pour permettre l’attaque des liaisons C 漣H et, par suite, favorisent l’autoxydation du composé R 漣H:
Certains hydroperoxydes sont peu stables et se décomposent spontanément en produits oxygénés. Au cours de cette transformation, il y a création de radicaux libres qui provoquent l’amorçage de nouvelles chaînes (chaînes ramifiées) et accroissent ainsi la vitesse de l’autoxydation.CatalyseLa scission homolytique de la liaison R 漣H d’un composé autoxydable peut être obtenue de diverses manières:– par irradiation ultraviolette : l’absorption d’énergie lumineuse par la substance autoxydable facilite la rupture de la liaison R 漣H;漣 par action de catalyseurs : les peroxydes organiques, en particulier le peroxyde de benzoyle, fournissent, par décomposition thermique, des radicaux libres suffisamment réactifs pour permettre l’attaque des liaisons C 漣H et, par suite, favorisent l’autoxydation du composé R 漣H: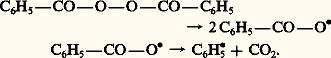 Le radical libre C6H 鍊5 formé réagit avec le composé R 漣H:
Le radical libre C6H 鍊5 formé réagit avec le composé R 漣H: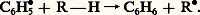 Des peroxydes peuvent également se former dans le milieu par autoxydation des substances R 漣H: il se produit alors une autocatalyse.D’autres substances (chlore, sels de certains métaux: manganèse, fer, cobalt, cuivre, plomb, etc.) constituent également des catalyseurs d’autoxydation.3. Effet antioxygèneDe nombreuses substances végétales, altérables à l’air de par leur constitution chimique, se trouvent protégées naturellement par la présence de petites quantités de certains composés reconnus maintenant comme étant des antioxygènes. C’est le cas, entre autres, de diverses huiles ou graisses végétales et du latex de caoutchouc.La première démonstration expérimentale de l’effet antioxygène a été fournie par les travaux de C. Moureu et C. Dufraisse (1917) sur l’autoxydation des aldéhydes. L’aldéhyde benzoïque, composé autoxydable, peut être protégé de l’action de l’oxygène par addition d’une petite quantité d’une substance phénolique, par ailleurs oxydable, le pyrogallol.De nombreuses études ont été effectuées depuis et ont permis d’établir que les antioxygènes agissent en tant que catalyseurs négatifs de l’autoxydation.Les substances antioxygènes sont des accepteurs de radicaux libres qui réagissent avec ceux-ci dès leur formation en donnant des radicaux libres doués d’une faible réactivité:
Des peroxydes peuvent également se former dans le milieu par autoxydation des substances R 漣H: il se produit alors une autocatalyse.D’autres substances (chlore, sels de certains métaux: manganèse, fer, cobalt, cuivre, plomb, etc.) constituent également des catalyseurs d’autoxydation.3. Effet antioxygèneDe nombreuses substances végétales, altérables à l’air de par leur constitution chimique, se trouvent protégées naturellement par la présence de petites quantités de certains composés reconnus maintenant comme étant des antioxygènes. C’est le cas, entre autres, de diverses huiles ou graisses végétales et du latex de caoutchouc.La première démonstration expérimentale de l’effet antioxygène a été fournie par les travaux de C. Moureu et C. Dufraisse (1917) sur l’autoxydation des aldéhydes. L’aldéhyde benzoïque, composé autoxydable, peut être protégé de l’action de l’oxygène par addition d’une petite quantité d’une substance phénolique, par ailleurs oxydable, le pyrogallol.De nombreuses études ont été effectuées depuis et ont permis d’établir que les antioxygènes agissent en tant que catalyseurs négatifs de l’autoxydation.Les substances antioxygènes sont des accepteurs de radicaux libres qui réagissent avec ceux-ci dès leur formation en donnant des radicaux libres doués d’une faible réactivité: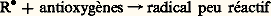 ou:
ou: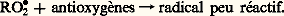 Un autre mode d’action est également possible: l’antioxygène (représenté par la formule A 漣H) peut céder un atome d’hydrogène au radical R 鍊 (ou RO 鍊2). Il se forme un nouveau radical libre peu réactif:
Un autre mode d’action est également possible: l’antioxygène (représenté par la formule A 漣H) peut céder un atome d’hydrogène au radical R 鍊 (ou RO 鍊2). Il se forme un nouveau radical libre peu réactif: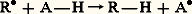 ou:
ou: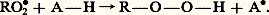 Les deux processus conduisent au même résultat: l’inhibition de la réaction par empêchement de la propagation de la chaîne, les radicaux libres résultants n’étant pas suffisamment réactifs pour attaquer une liaison C 漣H du composé autoxydable. Il en résulte une prolongation importante de la période d’induction: la substance autoxydable est stabilisée.Du point de vue pratique, la période d’induction peut être considérée comme la durée de vie utile des substances autoxydables.Une particularité à mettre en évidence est la parenté des catalyses inverses: un même catalyseur peut être capable de favoriser ou d’entraver la réaction d’autoxydation, selon la substance mise en œuvre. Ainsi, l’oxybromure de phosphore POBr3 constitue un antioxygène efficace pour l’aldéhyde benzoïque et un puissant accélérateur de l’autoxydation du styrène (il fonctionne alors comme «pro-oxygène»). Le choix d’un antioxygène, pour protéger un composé donné, nécessite donc une étude minutieuse. Des exemples d’antioxygènes utilisés industriellement seront donnés plus loin.4. Applications des antioxygènesPour qu’un antioxygène puisse être considéré comme satisfaisant dans la pratique, il faut qu’il réponde à certaines exigences qui dépendent de son emploi particulier. Les principaux critères sont: la solubilité dans le produit à protéger, la volatilité faible, la stabilité à la lumière, l’absence de coloration propre, d’odeur, de goût, de toxicité et de propriétés irritantes pour la peau. En outre, l’antioxygène ne doit pas être trop coûteux.Les antioxygènes sont utilisés sur une grande échelle pour protéger de l’autoxydation un grand nombre de produits. On les emploie principalement pour lutter contre:– le «vieillissement» du caoutchouc. On utilise surtout des amines: la N -phényl- 廓-naphtylamine, la 4,4 -diméthoxydiphényl-amine, la N,N -diphényl-para -phénylènediamine et aussi des phénols, notamment le 2,2 -méthylène bis (4-méthyl-6-tert -butylphénol), ce dernier étant stable à la lumière. On les incorpore au caoutchouc à la dose de 0,5 à 3 p. 100 en poids;– le «gommage» des carburants. Le N -butyl-para -aminophénol et la N,N -di-(sec -butyl)-para -phénylènediamine sont des antioxygènes efficaces à la dose de 0,001 à 0,01 p. 100;– le «cognement» des moteurs à combustion interne, phénomène dû à la formation de peroxydes lors de la compression. Lesantidétonants , tel le tétraéthylplomb, jouissent de propriétés antioxygènes;– le «rancissement» des graisses. Dans l’industrie alimentaire, la Communauté économique européenne autorise l’emploi de l’acide L-ascorbique, de ses sels et ses dérivés acylés (E 300-304), des extraits naturels de tocophérols (E 306), des tocophérols de synthèse (E 307-309) et des esters de l’acide galique (E 310-312) entre autres.Enfin, on peut utiliser les antioxygènes, en particulier l’hydroquinone, pour assurer la stabilisation des monomères vinyliques dont l’autoxydation conduirait à la formation de peroxydes susceptibles d’amorcer prématurément la polymérisation.
Les deux processus conduisent au même résultat: l’inhibition de la réaction par empêchement de la propagation de la chaîne, les radicaux libres résultants n’étant pas suffisamment réactifs pour attaquer une liaison C 漣H du composé autoxydable. Il en résulte une prolongation importante de la période d’induction: la substance autoxydable est stabilisée.Du point de vue pratique, la période d’induction peut être considérée comme la durée de vie utile des substances autoxydables.Une particularité à mettre en évidence est la parenté des catalyses inverses: un même catalyseur peut être capable de favoriser ou d’entraver la réaction d’autoxydation, selon la substance mise en œuvre. Ainsi, l’oxybromure de phosphore POBr3 constitue un antioxygène efficace pour l’aldéhyde benzoïque et un puissant accélérateur de l’autoxydation du styrène (il fonctionne alors comme «pro-oxygène»). Le choix d’un antioxygène, pour protéger un composé donné, nécessite donc une étude minutieuse. Des exemples d’antioxygènes utilisés industriellement seront donnés plus loin.4. Applications des antioxygènesPour qu’un antioxygène puisse être considéré comme satisfaisant dans la pratique, il faut qu’il réponde à certaines exigences qui dépendent de son emploi particulier. Les principaux critères sont: la solubilité dans le produit à protéger, la volatilité faible, la stabilité à la lumière, l’absence de coloration propre, d’odeur, de goût, de toxicité et de propriétés irritantes pour la peau. En outre, l’antioxygène ne doit pas être trop coûteux.Les antioxygènes sont utilisés sur une grande échelle pour protéger de l’autoxydation un grand nombre de produits. On les emploie principalement pour lutter contre:– le «vieillissement» du caoutchouc. On utilise surtout des amines: la N -phényl- 廓-naphtylamine, la 4,4 -diméthoxydiphényl-amine, la N,N -diphényl-para -phénylènediamine et aussi des phénols, notamment le 2,2 -méthylène bis (4-méthyl-6-tert -butylphénol), ce dernier étant stable à la lumière. On les incorpore au caoutchouc à la dose de 0,5 à 3 p. 100 en poids;– le «gommage» des carburants. Le N -butyl-para -aminophénol et la N,N -di-(sec -butyl)-para -phénylènediamine sont des antioxygènes efficaces à la dose de 0,001 à 0,01 p. 100;– le «cognement» des moteurs à combustion interne, phénomène dû à la formation de peroxydes lors de la compression. Lesantidétonants , tel le tétraéthylplomb, jouissent de propriétés antioxygènes;– le «rancissement» des graisses. Dans l’industrie alimentaire, la Communauté économique européenne autorise l’emploi de l’acide L-ascorbique, de ses sels et ses dérivés acylés (E 300-304), des extraits naturels de tocophérols (E 306), des tocophérols de synthèse (E 307-309) et des esters de l’acide galique (E 310-312) entre autres.Enfin, on peut utiliser les antioxygènes, en particulier l’hydroquinone, pour assurer la stabilisation des monomères vinyliques dont l’autoxydation conduirait à la formation de peroxydes susceptibles d’amorcer prématurément la polymérisation.
Encyclopédie Universelle. 2012.
